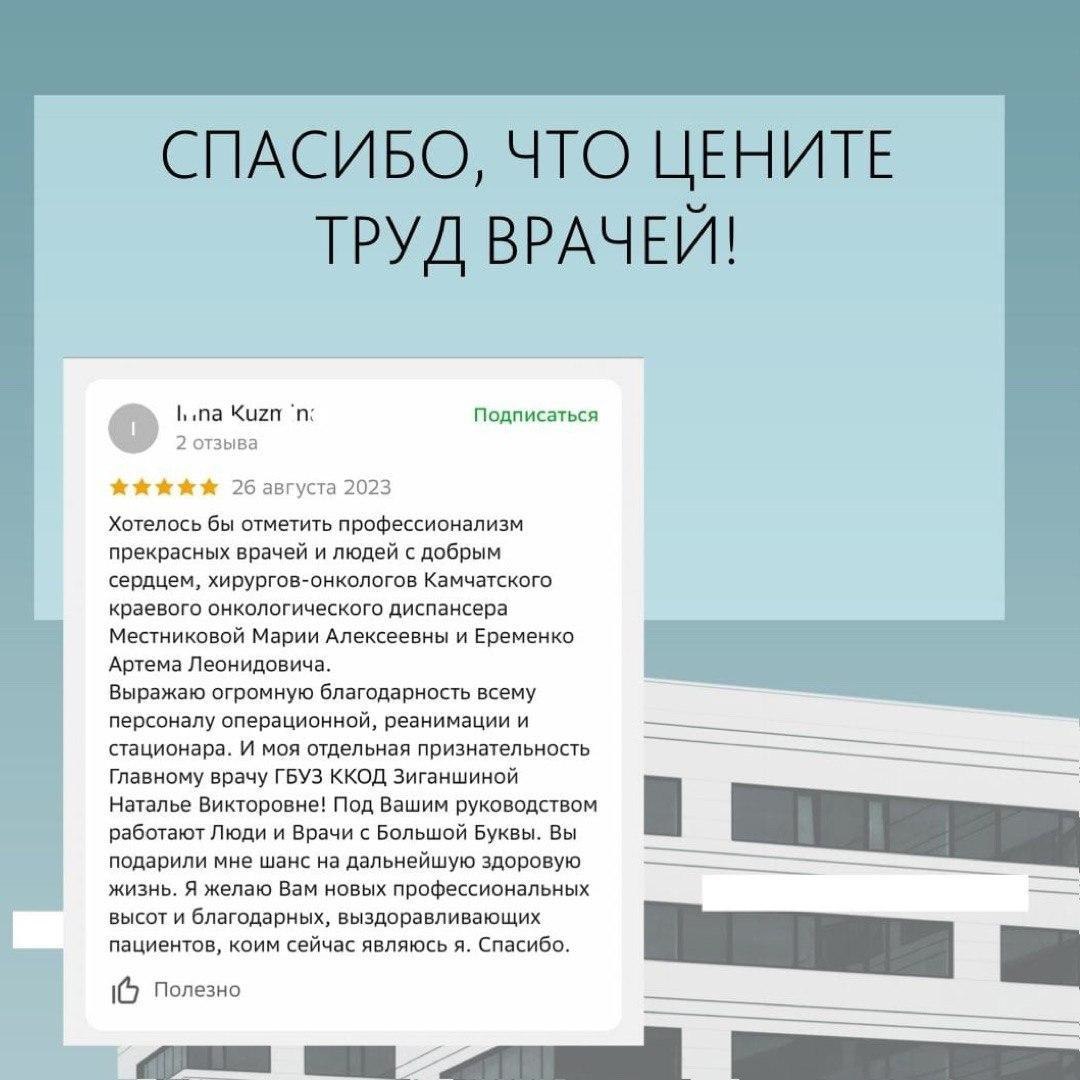
В России одобрили первый в своем классе препарат для лечения рака легкого.
Компания Amgen получила регистрационное удостоверение на препарат «Лумикрас» (МНН соторасиб), применяющийся у пациентов с немелкоклеточным раком легкого (НМРЛ) с мутацией KRAS, сообщил «Фармацевтический вестник» со ссылкой на Государственный реестр лекарственных средств. Препарат выпускается в таблетках в дозировке 120 мг.
«Лумикрас» содержит действующее вещество соторасиб — противоопухолевый препарат, ингибитор мутации KRAS. Лекарственное средство используется для лечения пациентов с местнораспространенным или метастатическим НМРЛ, у которых возникло генетическое изменение, вызвавшее появление аномального белка KRAS G12C, который способствует неконтролируемому росту раковых клеток. Соторасиб, связываясь с этим белком, блокирует его активность, что позволяет замедлить или остановить рост раковых клеток.
«Лумикрас» необходимо принимать один раз в сутки по 8 таблеток (960 мг). Препарат противопоказан до 18 лет, а также беременным и кормящим матерям.
Среди самых частых побочных действий препарата диарея, тошнота, рвота, усталость и др. Также к частым серьезным реакциям можно отнести поражение печени, которое определяется повышенным уровнем печеночных ферментов (АСТ/АЛТ) в крови.
Amgen получила ускоренное одобрение на «Лумикрас» в США в 2021 году. Основанием стали первоначальные результаты исследования с участием 124 человек с НМРЛ с мутацией KRAS G12C, которые ранее получали другие виды лечения. В клиническом испытании, получившем название CodeBreaK 100, соторасиб способствовал уменьшению опухоли у 36% участников.
Результаты первого клинического испытания III фазы соторасиба (Lumakras) CodeBreaK 200 были представлены в сентябре 2022 года на ежегодном собрании Европейского общества медицинской онкологии (ESMO).
Источник: https://clck.ru/ETso4
#онкологический_диспансер #ККОД
Компания Amgen получила регистрационное удостоверение на препарат «Лумикрас» (МНН соторасиб), применяющийся у пациентов с немелкоклеточным раком легкого (НМРЛ) с мутацией KRAS, сообщил «Фармацевтический вестник» со ссылкой на Государственный реестр лекарственных средств. Препарат выпускается в таблетках в дозировке 120 мг.
«Лумикрас» содержит действующее вещество соторасиб — противоопухолевый препарат, ингибитор мутации KRAS. Лекарственное средство используется для лечения пациентов с местнораспространенным или метастатическим НМРЛ, у которых возникло генетическое изменение, вызвавшее появление аномального белка KRAS G12C, который способствует неконтролируемому росту раковых клеток. Соторасиб, связываясь с этим белком, блокирует его активность, что позволяет замедлить или остановить рост раковых клеток.
«Лумикрас» необходимо принимать один раз в сутки по 8 таблеток (960 мг). Препарат противопоказан до 18 лет, а также беременным и кормящим матерям.
Среди самых частых побочных действий препарата диарея, тошнота, рвота, усталость и др. Также к частым серьезным реакциям можно отнести поражение печени, которое определяется повышенным уровнем печеночных ферментов (АСТ/АЛТ) в крови.
Amgen получила ускоренное одобрение на «Лумикрас» в США в 2021 году. Основанием стали первоначальные результаты исследования с участием 124 человек с НМРЛ с мутацией KRAS G12C, которые ранее получали другие виды лечения. В клиническом испытании, получившем название CodeBreaK 100, соторасиб способствовал уменьшению опухоли у 36% участников.
Результаты первого клинического испытания III фазы соторасиба (Lumakras) CodeBreaK 200 были представлены в сентябре 2022 года на ежегодном собрании Европейского общества медицинской онкологии (ESMO).
Источник: https://clck.ru/ETso4
#онкологический_диспансер #ККОД
Источник: https://vk.com/wall-211490277_177
Пост №391, опубликован 11 окт 2023